- Santiago Vega Melissa Iricel
- Cobix Xolo Audy
- Romero Suárez Irene Doraliz
- Cardoza Berdón Oliver Sergio
- Aguilera Cobaxin Abdias de Jesús
- Mendoza Carvajal Yeddani Itzel
- Capi Peralta Antonio de Jesús
- Temich García Roney Moises
ITSSAT. IND. QUIMICA I
Temas De Quimica
viernes, 25 de agosto de 2017
INTEGRANTES
INTEGRANTES
jueves, 24 de agosto de 2017
1.11.Propiedades atómicas y variaciones periódicas: Carga Nuclear Efectiva, Radio Atómico, Radio Ionico, Potencial de Ionización, Afinidad Electrónica, Electronegatividad.
Propiedades atomicas y variaciones periodicas.
La Tabla Periódica puede usarse para distintos fines,en particular es útil para relacionar las propiedades de los átomos a escalas atómica. Las variaciones de la tabla periódica dependen de las configuraciones electrónicas, en especial de la configuración de la capa externa ocupada y de su distancia con respecto al núcleo.
En este caso consideramos las siguientes propiedades periódicas:
Carga Nuclear Efectiva
En los átomos polielectrónicos, los
protones que se encuentran en el núcleo no ejercen la misma fuerza de atracción
sobre todos los electrones por igual. Esto se debe a los efectos pantalla que
causan los electrones más cercanos al núcleo sobre los que se encuentran más
alejados. Se le llama carga nuclear efectiva a la diferencia entre la carga
nuclear neta (que depende del número atómico del elemento) y la constante del
efecto pantalla s, es la fuerza real que ejerce
el núcleo sobre un electrón en particular.
También influyen en este efecto los
electrones que se encuentran en el mismo nivel de energía que el electrón
considerado. No tienen influencia en esta constante los electrones que se
hallan en niveles de energía.
La carga nuclear efectiva puede
calcularse según las reglas de Slater, quien las formuló en 1930:
·
Los electrones ubicados en un orbital de mayor nivel contribuyen en 0
(para la sumatoria que da como resultado la constante de apantallamiento s)
·
Cada electrón en el mismo nivel contribuye en 0,35.(excepto si el nivel
es 1s, que resta 0,30).
·
Electrones en el nivel inmediato inferior, si están en orbitales s o p contribuyen en 0,85, si son de
orbitales d o f contribuyen en 1,0 cada uno.
· Electrones
por debajo del nivel inmediato inferior, contribuyen en 1,0 cada uno.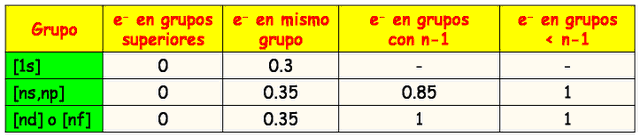


Entonces, para calcular la carga
nuclear efectiva, primero, situamos los electrones del átomo en sus orbitales
atómicos:
1s, 2s,2p, 3s,3p,3d,4s,4p, 4d, 4f, etc.
Luego, para el cálculo de la carga
nuclear efectiva sobre un electrón determinado, debemos calcular s y para ello tomamos en
consideración los electrones que se encuentran en niveles de energía
inferiores o iguales, que son los que causan apantallamiento del mismo,
como indica la tabla de arriba, según las reglas de Slater.
Entonces, por ejemplo para
calcular la carga nuclear efectiva sobre un electrón 4s del átomo de Zinc
(número atómico 30), primero debemos ubicar los electrones en los orbitales
atómicos correspondientes:
1s2 2s2 2p6 3s2
3p6 3d10 4s2
Luego calcular el valor que cada
electrón del mismo nivel y de niveles inferiores va a restar a la carga nuclear
total, esto es, según la tabla de arriba:
1 electrón en el nivel 4s..…………………..resta 0,35
8 electrones en el nivel 3 s y 3 p ………..restan
0,85 cada uno
10 electrones en el nivel 3d..……………..restan 1,0 cada uno
8 electrones en el nivel 2 s y 2 p.…………restan 1,0
cada uno
.
2 electrones en el nivel 1s…………………..restan 1,0 cada uno.
Entonces calculamos s :
s= (1 . 0,35) + (20 . 1) + (8 .
0,85)=27,15
La carga nuclear efectiva para un
electrón del orbital 4s de Zinc sería
Z ef= 30 – 27,15= 2,85
Este cálculo se sencillo, aunque no es
exacto, dado que Slater consideró los electrones de orbitales s y p con el mismo
valor, lo que no es exactamente así.
Radio Atómico
Muchas
propiedades físicas como la densidad, puntos de ebullición y de fusión tienen
relación con el tamaño del átomo, la densidad electrónica se extiende mas allá
del núcleo por lo cual se piensa en el tamaño atómico como el volumen que
contiene cerca de 90% de la densidad electrónica alrededor del núcleo.
Al
querer dar más detalles se proporciona el tamaño del átomo
en términos de radio atómico, siendo esta la mitad de la distancia entre
dos núcleos de dos átomos.
Átomos
unidos entre sí en una red tridimensional: su radio es solo la
mitad de
la distancia de un núcleo a otro de dos átomos vecinos.
Elementos
existentes como moléculas diatómicas simples: su radio
será la
mitad de la distancias entre núcleos de dos átomos de una molécula.
Radio Iónico:
Es el
radio de los cationes y aniones. Se mide por difracción de rayos X.
El radio
iónico afecta propiedades químicas y físicas de los
compuestos
iónicos.
Un átomo
neutro que se convierte en un ion, se espera que cambie su radio, si forma un
anión el radio aumenta (por la carga nuclear es constante pero la repulsión
resultante aumenta la nube electrónica).
Potencial de ionización:
Existe una
relación entre la configuración electrónica y el comportamiento químico. La
estabilidad de los electrones es reflejada en la energía de ionización de los
átomos.
La energía
de ionización es la energía mínima es expresada en kj/mol, Esta es la
cantidad de energía necesaria para separar un mol de electrones de un mol de
átomos en estado gaseoso.
Afinidad Electrónica
Es la capacidad de un átomo de aceptar uno o más electrones, Es un cambio de energía que sucede cuando un átomo en estado gaseoso acepta un electrón en forma de anión.

Electronegatividad:
Es la capacidad que tiene un átomo para atraer electrones. De la misma manera que la afinidad electrónica y la energía de ionización, la electronegatividad aumenta hacia arriba y ala derecha en la tabla periódica.

1.12 PROPIEDADES QUÍMICAS Y SU VARIACIÓN PERIÓDICA.
El número atómico indica el número de protones en la cortaza de un átomo. El número atómico es un concepto importante de la química y de la mecánica cuántica.
El elemento y el lugar que éste ocupa en la tabla periódica derivan de este concepto. Cuando un átomo es generalmente eléctricamente neutro, el número atómico será igual al número de electrones del átomo que se pueden encontrar alrededor de la corteza. Estos electrones determinan principalmente el comportamiento químico de un átomo. Los átomos que tienen carga eléctrica se llaman iones. Los iones pueden tener un número de electrones más grande (cargados negativamente) o más pequeño (cargados positivamente) que el número atómico.
El nombre indica la masa atómica de un átomo, expresada en unidades de masa atómica (umas). Cada isótopo de un elemento químico puede variar en masa. La masa atómica de un isótopo indica el número de neutrones que están presentes en la corteza de los átomos. La masa atómica indica el número partículas en la corteza de un átomo; esto quiere decir los protones y los neutrones. La masa atómica total de un elemento es una media ponderada de las unidades de masa de sus isótopos. La abundancia relativa de los isótopos en la naturaleza es un factor importante en la determinación de la masa atómica total de un elemento.
La electronegatividad mide la tendencia de un átomo para atraer la nube electrónica hacia sí durante el enlace con otro átomo.
La escala de Pauling es un método ampliamente usado para ordenar los elementos químicos de acuerdo con su electro negatividad. El premio Nobel Linus Pauling desarrolló esta escala en 1932.
Los valores de electronegatividad no están calculados, ni basados en formulas matemáticas ni medidas. Es más que nada un rango pragmático.
Pauling le dio un valor de 4,0 al elemento con la electronegatividad más alta posible, el flúor. Al francio, el elemento con la electronegatividad más baja posible, se le dio un valor de 0,7. A todos los elementos restantes se les dio un valor entre estos dos extremos.
La densidad de un elemento indica el número de unidades de masa del alemento que están presentes en cierto volumen de un medio. Tradicionalmente la densidad se expresa a través de la letra griega “ro” (escrita r). Dentro del sistema internacional de unidades (SI) la densidad se expresa en kilogramos por metro cúbico (kg/m3). La densidad de un elemento se expresa normalmente de forma gráfica con temperaturas y presiones del aire, porque ambas propiedades influyen en la densidad.
El punto de fusión de un elemento o compuesto es la temperatura a la cual la forma sólida del elemento o compuesto se encuentra en equilibrio con la forma líquida. Normalmente se asume que la presión del aire es de 1 atmósfera.
Por ejemplo: el punto de fusión del agua es de 0oC, o 273 K.
El punto de ebullición de un elemento o compuesto significa la temperatura a la cualla forma líquida de un elemento o compuesto se encuentra en equilibrio con la forma gaseosa. Normalmente se asume que la presión del aire es de 1 atmósfera.
Por ejemplo: el punto de ebullición del agua es de 100oC, o 373 K.
En el punto de ebullición la presión de un elemento o compuesto es de 1 atmósfera.
Incluso si dos átomos cercanos no se unen, se atraerán entre sí. Este fenómeno es conocido como fuerza de Vanderwaals.
Las fuerzas de Vanderwaals provocan una fuerza entre los dos átomos. Esta fuerza es más grande cuanto más cerca estén los átomos el uno del otro. Sin embargo, cuando los dos átomos se acercan demasiado actuará una fuerza de repulsión, como consecuencia de la repulsión entre las cargas negativas de los electrones de ambos átomos. Como resultado, se mantendrá una cierta distancia entre los dos átomos, que se conoce normalmente como el radio de Vanderwaals.
A través de la comparación de los radios de Vanderwaals de diferentes pares de átomos, se ha desarrollado un sistema de radios de Vanderwaals, a través del cual podemos predecir el radio de Vanderwaals entre dos átomos, mediante una simple suma.
Es el radio que tiene un ión en un cristal iónico, donde los iones están empaquetados juntos hasta el punto que sus orbitales atómicos más externos están en contacto unos con otros. Un orbital es el área alrededor de un átomo donde, de acuerdo con la probabilidad de encontrar un electrón es máxima.
El número atómico no determina el número de neutrones en una corteza atómica. Como resultado, el número de neutrones en un átomo puede variar. Como resultado, los átomos que tienen el mismo número atómico pueden diferir en su masa atómica. Átomos del mismo elemento que difieren en su masa atómica se llaman isótopos (isotopos). Principalmente con los átomos más pesados que tienen un mayor número, el número de neutrones en la corteza puede sobrepasar al número de protones.
Isótopos del mismo elemento se encuentran a menudo en la naturaleza alternativamente o mezclados.
Un ejemplo: el cloro tiene un número atómico de 17, lo que básicamente significa que todos los átomos de cloro contienen 17 protones en su corteza. Existen dos isótopos. Tres cuartas partes de los átomos de cloro que se encuentran en la naturaleza contienen 18 neutrones y un cuarto contienen 20 neutrones. Los números atómicos de estos isótopos son: 17 + 18 = 35 y 17 + 20 = 37. Los isótopos se escriben como sigue: 35Cl y 37Cl.
Cuando los isótopos se denotan de esta manera el número de protones y neutrones no tienen que ser mencionado por separado, porque el símbolo del cloro en la tabla periódica (Cl) está colocado en la posición número 17. Esto ya indica el número de protones, de forma que siempre se puede calcular el número de electrones fácilmente por medio del número másico.
Existe un gran número de isótopos que no son estables. Se desintegrarán por procesos de decaimiento radiactivo. Los isótopos que son radiactivos se llaman radioisótopos.
La configuración electrónica de un átomo es una descripción de la distribución de los electrones en círculos alrededor de la corteza. Estos círculos no son exactamente esféricos; tienen una forma sinuosa. Para cada círculo la probabilidad de que un electrón se encuentre en un determinado lugar se describe por una fórmula matemática. Cada uno de los círculos tiene un cierto nivel de energía, comparado con la corteza. Comúnmente los niveles de energía de los electrones son mayores cuando están más alejados de la corteza, pero debido a sus cargas, los electrones también pueden influir en los niveles de energía de los otros electrones. Normalmente los círculos del medio se llenan primero, pero puede haber excepciones debido a las repulsiones.
Los círculos se dividen en capas y subcapas, que se pueden numerar por cantidades.
La energía de ionización es la energía que se requiere para hacer que un átomo libre o una molécula pierdan un electrón en el vacío. En otras palabras; la energía de ionización es una medida de la fuerza con la que un electrón se enlaza con otras moléculas. Esto involucra solamente a los electrones del círculo externo.
Aparte de la energía de la primera ionización, que indica la dificultad de arrancar el primer electrón de un átomo, también existe la medida de energía par ala segunda ionización. Esta energía de la segunda ionización indica el grado de dificultad para arrancar el segundo átomo.
También existe la energía de la tercera ionización, y a veces incluso la de la cuarta y quinta ionizaciones.
El potencial estándar es el potencial de una reacción redox, cuando está en equilibrio, con respecto al cero. Cuando el potencial estándar supera al cero, tenemos una reacción de oxidación. Cuando el potencial estándar supera al cero, tenemos una reacción de reducción. El potencial estándar de los electrones se expresa en voltios (V), mediante el símbolo V0
Tendencias periódicas de las propiedades de los elementos
PROPIEDADES PERIÓDICAS
Son las propiedades que dependen de los electrones del nivel más externo de un átomo. Se llaman periódicas porque se repiten en la tabla periódica al cabo de un cierto número de elementos por coincidir la configuración electrónica de la última capa.
El radio atómico es la distancia que existe entre el núcleo y la capa de valencia. Por medio del radio atómico es posible determinarse el tamaño del átomo. Se define como: “la mitad de la distancia de dos átomos iguales que están enlazados entre sí”.
En un grupo, el volumen atómico aumenta al aumentar el nº atómico, pues aumenta el nº de capas.
En un periodo, el volumen atómico disminuye al aumentar el nº atómico ; ya que, para el mismo nº de capas aumenta la carga eléctrica del núcleo y de la corteza y por tanto la fuerza de atracción.
RADIO IÓNICO
· Es el radio que tiene un átomo cuando ha perdido o ganado electrones, adquiriendo la estructura electrónica del gas noble más cercano.
· Los cationes son menores que los átomos neutros por la mayor carga nuclear efectiva (menor apantallamiento o repulsión electrónica). Cuanto mayor sea la carga, menor será el ion; así, en un mismo periodo, los metales alcalinotérreos serán menores que los alcalinos correspondientes, dado que en ambos casos existe el mismo apantallamiento, mientras que los alcalinotérreos superan en una unidad la carga nuclear de los alcalinos.
· Los aniones son mayores que los átomos neutros por la disminución de la carga nuclear efectiva (mayor apantallamiento o repulsión electrónica). Cuanto mayor sea la carga, mayor será el Ion; así, en un mismo periodo, los anfígenos serán mayores que los halógenos correspondientes, dado que en ambos casos existe el mismo apantallamiento, mientras que los halógenos superan en una unidad la carga nuclear de los anfígenos.
· En general, entre los iones con igual número de electrones (isoelectrónicos) tiene mayor radio el de menor número atómico, pues la fuerza atractiva del núcleo es menor al ser menor su carga.
POTENCIAL O ENERGÍA DE IONIZACIÓN:
La energía de ionización (E.I.) es la mínima energía requerida para arrancar un electrón de un átomo gaseoso en su estado fundamental (de mínima energía) y formándose en catión.
En un grupo, la energía de ionización disminuye al aumentar el nº atómico ; pues al aumentar el número de capas, los electrones más externos están menos atraídos por el núcleo y, por tanto, es menor la energía necesaria para separarlos.
En un periodo, aumenta al aumentar el número atómico; pues para la misma capa, a mayor nº atómico más atraídos por el núcleo estarán los electrones.
ELECTRONEGATIVIDAD Y CARÁCTER METALICO
La electronegatividad es una medida de la fuerza de atracción que ejerce un átomo sobre los electrones de otro en un enlace covalente. Los diferentes valores de electronegatividad se clasifican según diferentes escalas, entre ellas la escala de Pauling.
En general, los diferentes valores de electronegatividad de los átomos determinan el tipo de enlace que se formará en la molécula que los combina.
Alta electronegatividad: NO METALES
Baja electronegatividad: METALES
CARÁCTER METÁLICO
Desde el punto de vista químico, los metales se caracterizan:
· Son elementos con pocos electrones en su nivel más externo.
· Tienen tendencia a perder electrones y formar iones positivos, son poco electronegativos.
· Se oxidan fácilmente, son reductores; forman óxidos básicos.
Mientras que los no metales:
· Son elementos con muchos electrones en su nivel más externo.
· Tienen tendencia a ganar electrones y formar iones negativos, son muy electronegativos.
· Se reducen fácilmente, son oxidantes; forman óxidos ácidos.
Variación de las propiedades de los elementos de la tabla periódica
A medida que desciende en un grupo, al pasar de un período a otro, se pasa de un número cuántico principal al siguiente.
Observando la línea quebrada que parte del boro y termina entre el polonio y el astato, vemos que a la derecha de la misma están los elementos no metálicos y a la izquierda los metálicos. Los elementos anfóteros o metaloides están a un lado y a otro de la diagonal.
Características periódicas de propiedades físicas
¿Cómo varía el radio atómico?
Numerosas propiedades físicas (densidad, punto de fusión y punto de ebullición) están relacionadas con el tamaño de los átomos, pero el tamaño atómico es difícil de definir. La densidad electrónica en el átomo se extiende más allá del núcleo. En la práctica, por lo general se piensa en tamaño atómico como el volumen que contiene un 90% de la totalidad de la densidad electrónica alrededor del núcleo.
El radio atómico de un metal es la mitad de la distancia entre dos núcleos de dos átomos adyacentes. Para elementos que existen como moléculas diatómicas simples, el radio atómico es la mitad de la distancia entre los núcleos de los dos átomos en una molécula específica.
La tabla periódica indica que el radio atómico disminuye de izquierda a derecha en un período y aumenta al descender en un grupo. La disminución de izquierda a derecha en un período es consecuencia del aumento de la atracción entre el núcleo y los electrones (n es el mismo y aumenta la carga nuclear, Z). Al descender en un grupo aumenta n, los electrones externos están cada vez más lejos del núcleo.
Radio iónico es el radio de un catión o de un anión. El radio iónico afecta las propiedades físicas y químicas de un compuesto iónico.
Energía de ionización o potencial de ionización es la energía mínima necesaria para arrancar un electrón en estado fundamental de un átomo en estado gaseoso para transformarlo en un catión.
Me (g) ---Me+ (g) + e- EI
¿Cómo varía la energía de ionización?
Aumenta de izquierda a derecha en un período, ya que el radio atómico disminuye y se consume más energía para arrancar el electrón que está más atraído por el núcleo.
Disminuye al descender en un grupo, ya que los electrones externos están cada vez más alejados del núcleo.
Afinidad electrónica es la energía puesta en juego cuando un átomo en estado fundamental y gaseoso se le agrega un electrón.
E(g) + e- ---- E-(g) AE
¿Cuándo decimos que un elemento es electronegativo?
El elemento con valores de energía de ionización y afinidad electrónica altos, es electronegativo.
La electronegatividad es una medida de tendencia que tienen los átomos de atraer los electrones de un enlace. Linus Pauling fue quien confeccionó una escala de electronegatividades para los elementos. Esta escala no tiene unidades y el máximo valor (4) corresponde al elemento más electronegativo.
1.13. Elementos de Importancia Económica, Industrial y Ambiental en La región o en el país.
Elementos de la importancia Económica
Algunos de los principales usos del hidrógeno son;
- Para la producción de
amoniaco (N3H) por el proceso (Haber)
- En la producción del ácido clorhídrico al combinarse con cloro, en la síntesis del alcohol metilito (CH3OH) al combinar con monóxido de carbono.
- Refinación de Petróleo.
Boro (B)
Este elemento no es metal, algunos de los usos qu se le da a este elemento es para fertilizante de foliar y Edático.

 Se usan Nitruro de Boro, Carburo de Boro y boruros metálicos en la fabricación de hojas de sierra especiales y ruedas abrasivas debido a su extrema dureza y abrasividad. También se puede ser utilizado para curar herramientas de diamante.
Se usan Nitruro de Boro, Carburo de Boro y boruros metálicos en la fabricación de hojas de sierra especiales y ruedas abrasivas debido a su extrema dureza y abrasividad. También se puede ser utilizado para curar herramientas de diamante.
Carbono (C)
 Este elemento es metal y es importante ya que forma parte de nuestro compuesto y que son importantes para la vida cotidiana del ser humano. También forma parte de las estructuras de las grasas o lipidos de la cual la parte estructural esta formada por el glicerol y glicerina el cual es el alcohol. El carbono también forma parte de las estructuras de ácidos nucleicos, vitaminas.
Este elemento es metal y es importante ya que forma parte de nuestro compuesto y que son importantes para la vida cotidiana del ser humano. También forma parte de las estructuras de las grasas o lipidos de la cual la parte estructural esta formada por el glicerol y glicerina el cual es el alcohol. El carbono también forma parte de las estructuras de ácidos nucleicos, vitaminas.
El principal uso industrial del carbono es como un componente de hidrocarburos, especialmente los combustibles fuciles (petróleo y gas natural). Del primero se obtiene, por destilación en las refinerías, gasolinas, queroseno y aceites, siendo ademas la materia prima empleada en la obtención de los platico.
Nitrógeno (N)

 La mayor parte del Nitrógeno se encuentra en el aire del atmósfera y se usa para fabricar amoniaco al combinarse con el hidrógeno en su forma liquida, el nitrógeno se utiliza como congelarte.
La mayor parte del Nitrógeno se encuentra en el aire del atmósfera y se usa para fabricar amoniaco al combinarse con el hidrógeno en su forma liquida, el nitrógeno se utiliza como congelarte.Unos de los usos es la fabricación de fertilizantes, aunque también se utiliza para preparar algunos colorantes y para la fabricación de amoniaco. también es utilizado para inflar los paquetes que contienen alimentos, como patatas fritas y mantenerlos frescos mas tiempo ya que evita su descomposición por el oxigeno y otras sustancias. El nitrógeno liquido se usa en la investigación, para reducir temperatura y en algunos tratamientos dermatologicos.
Entre todos estos elementos también se encuentran los siguientes;
Oxigeno (O), Fluor (F), Cloro (Cl), Bromo (Br), Yodo (I).
Elementos de Importancia Industrial.
Aluminio (Al)

 Es resistente ala corrosión, se puede laminar e hilar por los que se emplea en la construcción de vehículos, aviones y utensilios domésticos. Se extrae de la bauxita por reducción eléctrica.
Es resistente ala corrosión, se puede laminar e hilar por los que se emplea en la construcción de vehículos, aviones y utensilios domésticos. Se extrae de la bauxita por reducción eléctrica. Estos son algunos usos del aluminio:
-Trasporte; como material estructural en aviones, automóviles, trenes de alta velocidad, metros, tanques, superestructuras de búsqueda y bicicletas.
-Estructuras portantes de aluminio de edificios.
-Embalaje de alimentos; papel de aluminio, latas, tetrabriks, etc.
-Carpintería metálica; puerta, ventana, cierres, armarios, etc.
-Bienes de usos domésticos; utensilio de cocina, herramientas, etc.
Cobalto (Co)


Se emplea en la elaboración de aceros especiales debido a su alta resistencia al calor, corrosión y fracción. Se emplea en herramientas mecánicas de alta velocidad, imanes y motores. En forma de polvo, se emplea como pigmento azul para el vidrio. Alguno de los usos es principalmente en aleaciones.
Una aleación con el acero, es conocida como acero de cobalto se usa para hacer imanes permanentes.con el carburo de wolfranio, el cobalto forma un material duro "carboloy) usado para cortar y elaborar acero.
Aleaciones térmica-mente muy resistente, llamadas super-aleaciones, que contiene cobalto se usan en la industria de motores y para las turbinas de los aviones y válvulas de motor.
Mercurio (HG)

 Es resistente ala corrosión y buen conductor eléctrico. Se usa en la fabricación de instrumento de presión, baterías, termómetro, barómetro, amalgamas dentales, sosa caustica, medicamentos e insecticidas.
Es resistente ala corrosión y buen conductor eléctrico. Se usa en la fabricación de instrumento de presión, baterías, termómetro, barómetro, amalgamas dentales, sosa caustica, medicamentos e insecticidas.
 Antimonio (Sb)
Antimonio (Sb)  Es un metal quebradizo, de color gris plateado. Tiene la propiedad de expandirse al congelarse, y su aplicación principal ha sido como constituyente d un tipo metal (82% de plomo, 15% de antimonio, 3% de estaño.
Es un metal quebradizo, de color gris plateado. Tiene la propiedad de expandirse al congelarse, y su aplicación principal ha sido como constituyente d un tipo metal (82% de plomo, 15% de antimonio, 3% de estaño. En su forma estable es un metal blanco azulado. El
En su forma estable es un metal blanco azulado. El antimonio negro y el amarillo son formas no metálicas inestables. principalmente se emplea en aleaciones metálicas y algunos de sus compuestos para dar resistencia contra el fuego, en pinturas, cerámicas, esmaltes, vulcanisación del caucho y fuego artificiales.
Entre todos estos elementos también se encuentran los siguientes;
el Cobre (Cu), Plata (Ag), Plomo (Pb), Hierro (Fe), Oro (Au).
Elementos de Importancia ambiental.
Bromo (Br)
 Es el único elemento no metálico a temperatura y precion normal. Es muy reactivo químicamente; elemento de grupo de los halógenos, sus propiedades son intermedias entre las del cloro y las del yodo.
Es el único elemento no metálico a temperatura y precion normal. Es muy reactivo químicamente; elemento de grupo de los halógenos, sus propiedades son intermedias entre las del cloro y las del yodo.

La mayor parte del bromo se encuentra en el mar, en forma de bromuro,Br.
El mar presenta una concentración de unos 65 μg/g
Azufre (S)

 Sus óxidos (SO2 Y SO3) Contamina el aire y mezclados con agua produce la lluvia ácida, Algunas sustancias como los derivados clorados, sulfatos y ácidos son corrosivos, el gas H2S es sumamente toxico y contamina el aire.
Sus óxidos (SO2 Y SO3) Contamina el aire y mezclados con agua produce la lluvia ácida, Algunas sustancias como los derivados clorados, sulfatos y ácidos son corrosivos, el gas H2S es sumamente toxico y contamina el aire.

Su uso principal es la fabricación de ácido sulfúrico (por el método de contacto), que a su vez se usa para hacer explosivos, pigmentos, jabones y detergentes, tintura y plástico. el ácido-sulfúrico es uno de los compuestos químicos industriales mas importantes porque se emplea tanto en la fabricación de compuesto sulfurados como en la de numerosos materiales que no contiene azufre, tal como ácido fosfórico. Se una también en la fabricación de cerillas, para el vulcanizado de coucho.
Cadmio (Cd)

 Es un contaminante del agua, Tiene efectos tóxicos en los riñones y en los sistemas oseo y respiratorio; ademas, esta clasificado como carcinogeno para los seres humanos.
Es un contaminante del agua, Tiene efectos tóxicos en los riñones y en los sistemas oseo y respiratorio; ademas, esta clasificado como carcinogeno para los seres humanos.

Este elemento puede recorrer grandes distancias desde la fuente de emisión a través del aire. Se acumula rápidamente en muchos organismos, principalmente músculos y crustáceos. También se puede encontrar concentraciones, aunque mas baja, en vejetales, cereales y tubérculos ricos en almidón.
Fósforo (P)

 Este elemento es un "no es un metal" solido, amarillento de olor desagradable, muy combustible y venenoso, que emite luz en la oscuridad; se presenta en tres formas alotrópicas; fósforo ordinario o blanco, fósforo rojo y fósforo negro; es muy abundante en la naturaleza, en donde no se da en estado puro, sino en forma de fosfatos; sus compuestos se usan como fertilizantes, para preparar raticidas y elaborar fósforo o cerillas.
Este elemento es un "no es un metal" solido, amarillento de olor desagradable, muy combustible y venenoso, que emite luz en la oscuridad; se presenta en tres formas alotrópicas; fósforo ordinario o blanco, fósforo rojo y fósforo negro; es muy abundante en la naturaleza, en donde no se da en estado puro, sino en forma de fosfatos; sus compuestos se usan como fertilizantes, para preparar raticidas y elaborar fósforo o cerillas.
Entre todos estos elementos también se encuentran los siguientes; Cloro (Cl), Magnesio (Mg)
 Es el único elemento no metálico a temperatura y precion normal. Es muy reactivo químicamente; elemento de grupo de los halógenos, sus propiedades son intermedias entre las del cloro y las del yodo.
Es el único elemento no metálico a temperatura y precion normal. Es muy reactivo químicamente; elemento de grupo de los halógenos, sus propiedades son intermedias entre las del cloro y las del yodo.
Azufre (S)

 Sus óxidos (SO2 Y SO3) Contamina el aire y mezclados con agua produce la lluvia ácida, Algunas sustancias como los derivados clorados, sulfatos y ácidos son corrosivos, el gas H2S es sumamente toxico y contamina el aire.
Sus óxidos (SO2 Y SO3) Contamina el aire y mezclados con agua produce la lluvia ácida, Algunas sustancias como los derivados clorados, sulfatos y ácidos son corrosivos, el gas H2S es sumamente toxico y contamina el aire.
Su uso principal es la fabricación de ácido sulfúrico (por el método de contacto), que a su vez se usa para hacer explosivos, pigmentos, jabones y detergentes, tintura y plástico. el ácido-sulfúrico es uno de los compuestos químicos industriales mas importantes porque se emplea tanto en la fabricación de compuesto sulfurados como en la de numerosos materiales que no contiene azufre, tal como ácido fosfórico. Se una también en la fabricación de cerillas, para el vulcanizado de coucho.
Cadmio (Cd)

 Es un contaminante del agua, Tiene efectos tóxicos en los riñones y en los sistemas oseo y respiratorio; ademas, esta clasificado como carcinogeno para los seres humanos.
Es un contaminante del agua, Tiene efectos tóxicos en los riñones y en los sistemas oseo y respiratorio; ademas, esta clasificado como carcinogeno para los seres humanos.
Este elemento puede recorrer grandes distancias desde la fuente de emisión a través del aire. Se acumula rápidamente en muchos organismos, principalmente músculos y crustáceos. También se puede encontrar concentraciones, aunque mas baja, en vejetales, cereales y tubérculos ricos en almidón.
Fósforo (P)

 Este elemento es un "no es un metal" solido, amarillento de olor desagradable, muy combustible y venenoso, que emite luz en la oscuridad; se presenta en tres formas alotrópicas; fósforo ordinario o blanco, fósforo rojo y fósforo negro; es muy abundante en la naturaleza, en donde no se da en estado puro, sino en forma de fosfatos; sus compuestos se usan como fertilizantes, para preparar raticidas y elaborar fósforo o cerillas.
Este elemento es un "no es un metal" solido, amarillento de olor desagradable, muy combustible y venenoso, que emite luz en la oscuridad; se presenta en tres formas alotrópicas; fósforo ordinario o blanco, fósforo rojo y fósforo negro; es muy abundante en la naturaleza, en donde no se da en estado puro, sino en forma de fosfatos; sus compuestos se usan como fertilizantes, para preparar raticidas y elaborar fósforo o cerillas. Entre todos estos elementos también se encuentran los siguientes; Cloro (Cl), Magnesio (Mg)
Suscribirse a:
Comentarios (Atom)















