Propiedades atomicas y variaciones periodicas.
La Tabla Periódica puede usarse para distintos fines,en particular es útil para relacionar las propiedades de los átomos a escalas atómica. Las variaciones de la tabla periódica dependen de las configuraciones electrónicas, en especial de la configuración de la capa externa ocupada y de su distancia con respecto al núcleo.
En este caso consideramos las siguientes propiedades periódicas:
Carga Nuclear Efectiva
En los átomos polielectrónicos, los
protones que se encuentran en el núcleo no ejercen la misma fuerza de atracción
sobre todos los electrones por igual. Esto se debe a los efectos pantalla que
causan los electrones más cercanos al núcleo sobre los que se encuentran más
alejados. Se le llama carga nuclear efectiva a la diferencia entre la carga
nuclear neta (que depende del número atómico del elemento) y la constante del
efecto pantalla s, es la fuerza real que ejerce
el núcleo sobre un electrón en particular.
También influyen en este efecto los
electrones que se encuentran en el mismo nivel de energía que el electrón
considerado. No tienen influencia en esta constante los electrones que se
hallan en niveles de energía.
La carga nuclear efectiva puede
calcularse según las reglas de Slater, quien las formuló en 1930:
·
Los electrones ubicados en un orbital de mayor nivel contribuyen en 0
(para la sumatoria que da como resultado la constante de apantallamiento s)
·
Cada electrón en el mismo nivel contribuye en 0,35.(excepto si el nivel
es 1s, que resta 0,30).
·
Electrones en el nivel inmediato inferior, si están en orbitales s o p contribuyen en 0,85, si son de
orbitales d o f contribuyen en 1,0 cada uno.
· Electrones
por debajo del nivel inmediato inferior, contribuyen en 1,0 cada uno.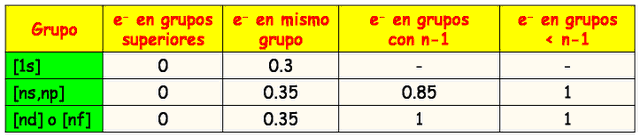


Entonces, para calcular la carga
nuclear efectiva, primero, situamos los electrones del átomo en sus orbitales
atómicos:
1s, 2s,2p, 3s,3p,3d,4s,4p, 4d, 4f, etc.
Luego, para el cálculo de la carga
nuclear efectiva sobre un electrón determinado, debemos calcular s y para ello tomamos en
consideración los electrones que se encuentran en niveles de energía
inferiores o iguales, que son los que causan apantallamiento del mismo,
como indica la tabla de arriba, según las reglas de Slater.
Entonces, por ejemplo para
calcular la carga nuclear efectiva sobre un electrón 4s del átomo de Zinc
(número atómico 30), primero debemos ubicar los electrones en los orbitales
atómicos correspondientes:
1s2 2s2 2p6 3s2
3p6 3d10 4s2
Luego calcular el valor que cada
electrón del mismo nivel y de niveles inferiores va a restar a la carga nuclear
total, esto es, según la tabla de arriba:
1 electrón en el nivel 4s..…………………..resta 0,35
8 electrones en el nivel 3 s y 3 p ………..restan
0,85 cada uno
10 electrones en el nivel 3d..……………..restan 1,0 cada uno
8 electrones en el nivel 2 s y 2 p.…………restan 1,0
cada uno
.
2 electrones en el nivel 1s…………………..restan 1,0 cada uno.
Entonces calculamos s :
s= (1 . 0,35) + (20 . 1) + (8 .
0,85)=27,15
La carga nuclear efectiva para un
electrón del orbital 4s de Zinc sería
Z ef= 30 – 27,15= 2,85
Este cálculo se sencillo, aunque no es
exacto, dado que Slater consideró los electrones de orbitales s y p con el mismo
valor, lo que no es exactamente así.
Radio Atómico
Muchas
propiedades físicas como la densidad, puntos de ebullición y de fusión tienen
relación con el tamaño del átomo, la densidad electrónica se extiende mas allá
del núcleo por lo cual se piensa en el tamaño atómico como el volumen que
contiene cerca de 90% de la densidad electrónica alrededor del núcleo.
Al
querer dar más detalles se proporciona el tamaño del átomo
en términos de radio atómico, siendo esta la mitad de la distancia entre
dos núcleos de dos átomos.
Átomos
unidos entre sí en una red tridimensional: su radio es solo la
mitad de
la distancia de un núcleo a otro de dos átomos vecinos.
Elementos
existentes como moléculas diatómicas simples: su radio
será la
mitad de la distancias entre núcleos de dos átomos de una molécula.
Radio Iónico:
Es el
radio de los cationes y aniones. Se mide por difracción de rayos X.
El radio
iónico afecta propiedades químicas y físicas de los
compuestos
iónicos.
Un átomo
neutro que se convierte en un ion, se espera que cambie su radio, si forma un
anión el radio aumenta (por la carga nuclear es constante pero la repulsión
resultante aumenta la nube electrónica).
Potencial de ionización:
Existe una
relación entre la configuración electrónica y el comportamiento químico. La
estabilidad de los electrones es reflejada en la energía de ionización de los
átomos.
La energía
de ionización es la energía mínima es expresada en kj/mol, Esta es la
cantidad de energía necesaria para separar un mol de electrones de un mol de
átomos en estado gaseoso.
Afinidad Electrónica
Es la capacidad de un átomo de aceptar uno o más electrones, Es un cambio de energía que sucede cuando un átomo en estado gaseoso acepta un electrón en forma de anión.

Electronegatividad:
Es la capacidad que tiene un átomo para atraer electrones. De la misma manera que la afinidad electrónica y la energía de ionización, la electronegatividad aumenta hacia arriba y ala derecha en la tabla periódica.



No hay comentarios:
Publicar un comentario